Resumen
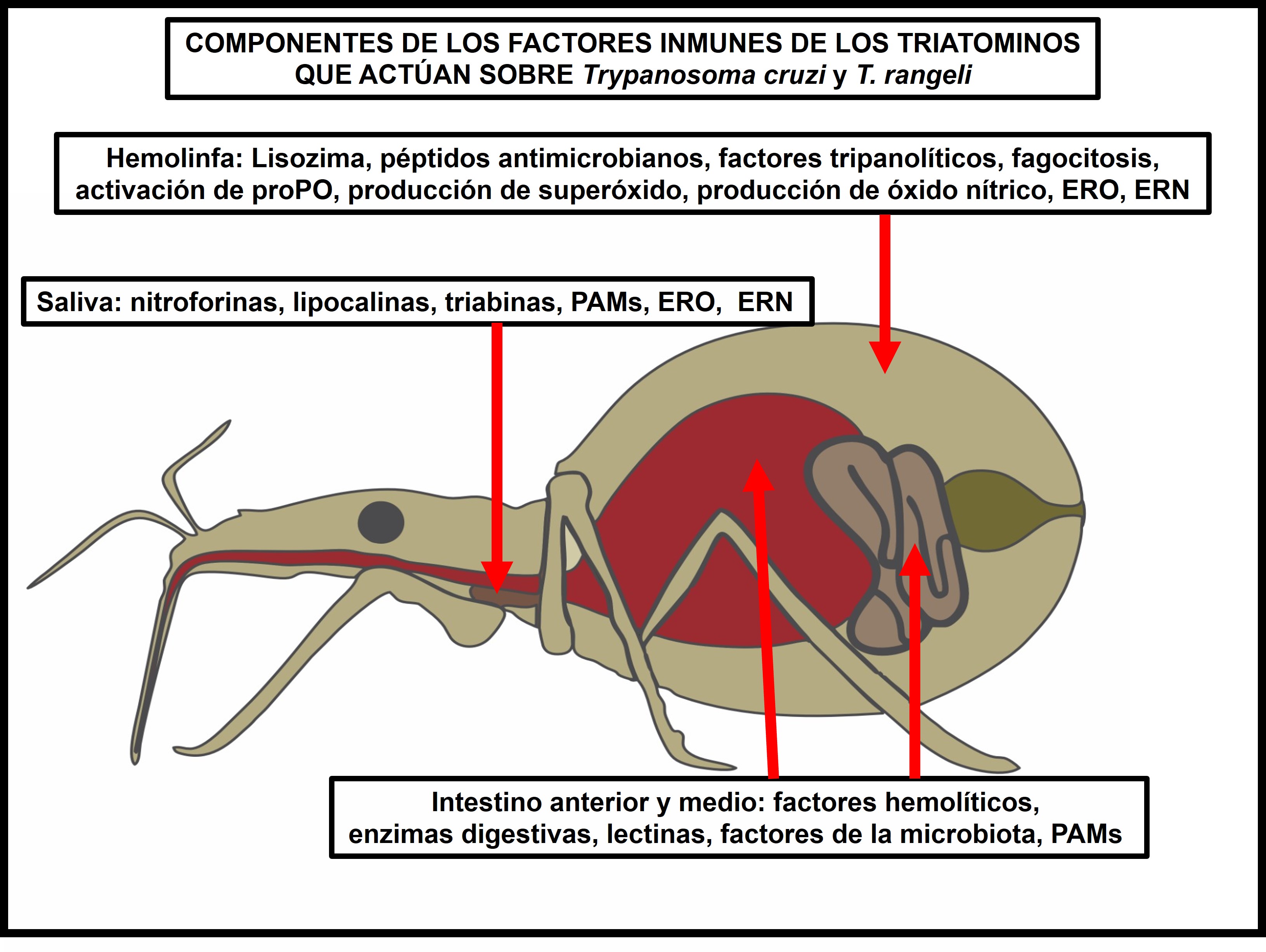
La respuesta inmune de los triatominos se expresa en la hemolinfa, la saliva y el intestino a través de los eicosanoides, el sistema profenoloxidasa, los péptidos antimicrobianos, las especies reactivas de oxígeno, las reactivas de nitrógeno y los factores de la microbiota intestinal. El género Rhodnius, conformado por 21 especies organizadas en tres grupos, pallescens, pictipes y prolixus, actúan como vectores de Trypanosoma cruzi y T. rangeli en diferentes regiones de Latinoamérica. En varios estudios se ha reportado la actividad lítica en la hemolinfa y en las glándulas salivales de Rhodnius prolixus y R. robustus, del grupo prolixus, contra algunos genotipos de T. cruzi y T. rangeli. Esta actividad lítica no se ha observado en las especies estudiadas de Triatoma y Panstrongylus ni en R. pallescens, R. colombiensis y R. ecuadoriensis del grupo pallescens, o R. pictipes del grupo pictipes. En estudios proteómicos de la hemolinfa y las glándulas salivales de R. prolixus y R. colombiensis se detectaron diferencias en proteínas de respuesta inmune que estarían asociadas con la actividad lítica. Esta respuesta inmune, además de los factores de la microbiota intestinal, la distribución geográfica de los vectores, y los genotipos del parásito, ha llevado a plantear la hipótesis de que el grupo prolixus está conformado por vectores con factores inmunes que determinan la transmisión selectiva de algunos genotipos de T. cruzi y T. rangeli, lo que ha modificado la distribución geográfica de estos parásitos en el continente americano. En esta revisión de la interacción parásito-vector, se presentan resultados publicados entre 1982 y 2023 para respaldar la hipótesis planteada.
Referencias
Alvarenga, N.J., Bronfen, E. (1982). Incapacidade de evolução do Trypanosoma cruzi na hemocele de triatomíneos [Incapacity of the evolution of Trypanosoma cruzi in the hemocele of triatomids]. Memórias do Instituto Oswaldo Cruz, 77(4), 431-6. https://doi.org/10.1590/s0074-02761982000400010
Amino, R., Martins, R.M., Procopio, J., Hirata, I.Y., Juliano, M.A., Schenkman, S. (2002). Trialysin, a novel pore-forming protein from saliva of hematophagous insects activated by limited proteolysis. Journal of Biological Chemistry, 277(8), 6207-13. https://doi.org/10.1074/jbc.M109874200
Arcà, B., Ribeiro, J.M. (2018). Saliva of hematophagous insects: a multifaceted toolkit. Current Opinion in Insect Science, 29, 102-109. https://doi.org/10.1016/j.cois.2018.07.012
Azambuja, P., Feder, D., Garcia, E.S. (2004). Isolation of Serratia marcescens in the midgut of Rhodnius prolixus: impact on the establishment of the parasite Trypanosoma cruzi in the vector. Experimental Parasitology, 107, 89-96. https://doi.org/10.1016/j. exppara.2004.04.007
Azambuja, P., Garcia, E.S., Waniek, P.J., Vieira, C.S., Figueiredo, M.B., Gonzalez, M.S., Mello, C.B., Castro, D.P., Ratcliffe, N.A. (2017). Rhodnius prolixus: from physiology by Wigglesworth to recent studies of immune system modulation by Trypanosoma cruzi and Trypanosoma rangeli. Journal of Insect Physiology, 97, 45-65. https://doi.org/10.1016/j. jinsphys.2016.11.006
Batista, K.K.D.S., Vieira, C.S., Florentino, E.B., Caruso, K.F.B., Teixeira, P.T.P., Moraes, C.D.S., Genta, F.A., de Azambuja, P., de Castro, D. P. (2020). Nitric oxide effects on Rhodnius prolixus’s immune responses, gut microbiota and Trypanosoma cruzi development. Journal of Insect Physiology, 126, 104100. https://doi.org/10.1016/j.jinsphys.2020.104100
Barbosa, H.J., Suárez, J., Meneses, A., Carranza, J.C., Vallejo, G.A. (2021). Análisis proteómico de la hemolinfa y las glándulas salivares en triatominos con capacidad lítica contra Trypanosoma rangeli y Trypanosoma cruzi. IX Congreso Internacional de Parasitología Neotropical COPANEO, 2021. (PDF) IX Congreso Internacional de Parasitología Neotropical, COPANEO 2021 Libro de resúmenes. (researchgate.net), 64
Barbosa Vinasco, H. J., Meneses, A., Suárez Quevedo, Y., Mario Ospina, C., Carranza, J.C., Vallejo, G.A. (2022). Identification of innate immune or biochemical factors in triatomines with lytic capacity against Trypanosoma rangeli and Trypanosoma cruzi. Revista Actualidades Biológicas, 44, 34.
Barbosa, H.J. (2023). Factores inmunes innatos en triatominos asociados con actividad lítica contra algunas cepas de Trypanosoma cruzi. Tesis para optar el título de Doctor en Ciencias Biomédicas. Universidad del Tolima. 135 pp.
Beltrame-Botelho, I.T., Talavera-López, C., Andersson, B., Grisard, E.C., Stoco, P.H. (2016). A Comparative In Silico Study of the Antioxidant Defense Gene Repertoire of Distinct Lifestyle Trypanosomatid Species. Evolutionary Bioinformatics Online, 12, 263-275. https:// doi.org/10.4137/EBO.S40648
Brenière, S.F., Waleckx, E., Barnabé, C. (2016). Over Six Thousand Trypanosoma cruzi Strains Classified into Discrete Typing Units (DTUs): Attempt at an Inventory. PLoS Neglected Tropical Diseases, 10(8), e0004792. https://doi.org/10.1371/journal.pntd.0004792
Carrasco, H.J., Segovia, M., Llewellyn, M.S., Morocoima, A., Urdaneta-Morales, S., Martínez, C., Martínez, C.E., Garcia, C., Rodríguez, M., Espinosa, R., de Noya, B.A., Díaz-Bello, Z., Herrera, L., Fitzpatrick, S., Yeo, M., Miles, M.A., Feliciangeli, M.D. (2012). Geographical distribution of Trypanosoma cruzi genotypes in Venezuela. PLoS Neglected Tropical Diseases, 6(6), e1707. https://doi.org/10.1371/journal.pntd.
Castro, D.P., Moraes, C.S., Gonzalez, M.S., Ratcliffe, N.A., Azambuja, P., Garcia, E.S. (2012). Trypanosoma cruzi immune response modulation decreases microbiota in Rhodnius prolixus gut and is crucial for parasite survival and development. PLoS ONE, 7(5), e36591. https://doi. org/10.1371/journal.pone.0036591
D’Alessandro, A. (1976). Biology of Trypanosoma (Herpetosoma) rangeli Tejera, 1920. In WHR Lumsden & DA Evans (editors), Biology of Kinetoplastida. Vol 1 (327-349) Academic Press, London, New York and San Francisco.
De Stefani-Márquez, M.D., Rodrigues-Ottaiano, C., Mônica Oliveira, R., Pedrosa, A.L., Cabrine-Santos, M., Lages-Silva, E., Ramírez, L.E. (2006). Susceptibility of different triatomine species to Trypanosoma rangeli experimental infection. Vector Borne and Zoonotic Diseases, 6(1), 50-56. https://doi.org/10.1089/vbz.2006.6.50
Ferreira, R. C., Kessler, R. L., Lorenzo, M. G., Paim, R. M. M., Ferreira, L. D. L., Probst, C. M., Alves-Silva, J., Guarneri, A. A. (2016). Colonization of Rhodnius prolixus gut by Trypanosoma cruzi involves an extensive parasite killing. Parasitology, 143(4), 434-443. https://doi.org/10.1017/S0031182015001857
Gaitán-Velosa, G.A. (2022). Efecto de los factores líticos de la hemolinfa de Rhodnius prolixus y Rhodnius colombiensis contra las formas tripomastigotas metacíclicas de Trypanosoma cruzi (DTUs I y II). Tesis para optar el título de Biólogo. 110 pp. Universidad del Tolima.
Galvão, C. (2021). Taxonomy. In: Guarneri, A., Lorenzo, M. (Eds) Triatominae – The Biology of Chagas Disease Vectores, Entomology in Focus 5. Springer, Cham, 15-38. https://doi. org/10.1007/978-3-030-64548-9_2
Garcia, E.S., Azambuja, P. (1991). Development and interactions of Trypanosoma cruzi within the insect vector. Parasitology Today. 7(9), 240-244. https://doi.org/10.1016/0169-4758(91)90237-i
Garcia, E.S., Ratcliffe, N.A., Whitten, M.M., Gonzalez, M.S., Azambuja P. (2007). Exploring the role of insect host factors in the dynamics of Trypanosoma cruzi-Rhodnius prolixus interactions. Journal of Insect Physiology. 53(1), 11-21. https://doi.org/10.1016/j.jinsphys.2006.10.006
Garcia, E.S., Castro, D.P., Figueiredo, M.B., Genta, F.A., Azambuja, P. (2009). Trypanosoma rangeli: a new perspective for studying the modulation of immune reactions of Rhodnius prolixus. Parasites & Vectors 2, 1-10. https://doi.org/10.1186/1756-3305-2-33/FIGURES/5.
Garcia, E.S., Castro, D.P., Figueiredo, M.B., Azambuja, P. (2010a). Immune homeostasis to microorganisms in the guts of triatomines (Reduviidae): a review. Memórias do Instituto Oswaldo Cruz, 105(5), 605-610.
Garcia, E.S., Genta, F.A., Azambuja, P., Schaub, G.A. (2010b). Interactions between intestinal compounds of triatomines and Trypanosoma cruzi. Trends in Parasitology. 26(10), 499-505. https://doi.org/10.1016/j.pt.2010.07.003
Gil-Santana, H.R., Chavez, T., Pita, S., Panzera, F., Galvão, C. (2022). Panstrongylus noireaui, a remarkable new species of Triatominae (Hemiptera, Reduviidae) from Bolivia. Zookeys, 1104, 203-225. https://doi.org/10.3897/zookeys.1104.81879
Guhl, F., Vallejo, G.A. (2003). Trypanosoma (Herpetosoma) rangeli Tejera, 1920: An updated review. Memórias do Instituto Oswaldo Cruz, 98(4), 435-442. https://doi.org/10.1590/s0074-02762003000400001
Guhl, F., Ramírez, J.D. (2013). Retrospective molecular integrated epidemiology of Chagas disease in Colombia. Infection Genetics and Evolution, 20, 148-54. https://doi.org/10.1016/j. meegid.2013.08.028
Gurgel-Gonçalves, R., Ramalho, E.D., Duarte, M.A., Palma, A.R., Abad-Franch, F., Carranza, J.C., Cuba Cuba, C.A. (2004). Enzootic transmission of Trypanosoma cruzi and T. rangeli in the Federal District of Brazil. Revista do Instituto de Medicina Tropical de São Paulo, 46(6), 323-30.https://doi.org/10.1590/s0036-46652004000600005
Hernández, C., da Rosa, JA, Vallejo, G.A., Guhl, F., Ramírez, J.D. (2020). Taxonomy, Evolution, and Biogeography of the Rhodniini Tribe (Hemiptera: Reduviidae). Diversity, 12, 97. https://doi.org/10.3390/d12030097
Justi, S.A., Galvão, C. (2017). The Evolutionary Origin of Diversity in Chagas Disease Vectors. Trends in Parasitology, 33(1), 42-52. https://doi.org/10.1016/j.pt.2016.11.002
Kieran, T.J., Arnold, K.M.H., Thomas, J.C., Varian, C.P., Saldaña, A., Calzada, J.E., Glenn, T.C., Gottdenker, N.L. (2019). Regional biogeography of microbiota composition in the Chagas disease vector Rhodnius pallescens. Parasites & Vectors, 12(1), 504. https://doi. org/10.1186/s13071-019-3761-8
Knipp, M., He, C. (2011). Nitrophorins: Nitrite disproportionation reaction and other novel functionalities of insect heme‐based nitric oxide transport proteins. IUBMB Life, 63(5), 304-312. https://doi.org/10.1002/iub.451
Kollien, A.H., Schaub, G.A. (2000). The development of Trypanosoma cruzi in triatominae. Parasitology Today. 16(9):381-387. https://doi.org/10.1016/s0169-4758(00)01724-5
Maia da Silva, F., Junqueira, A.C., Campaner, M., Rodrigues, A.C., Crisante, G., Ramírez, L.E., Caballero, Z.C., Monteiro, F.A., Coura, J.R., Añez, N., Teixeira, M.M. (2007). Comparative phylogeography of Trypanosoma rangeli and Rhodnius (Hemiptera: Reduviidae) supports a long coexistence of parasite lineages and their sympatric vectors. Molecular Ecology 16(16), 3361-3373. https://doi.org/10.1111/j.1365-294X.2007.03371.x
Maia da Silva, F., Marcili, A., Lima, L., Cavazzana Jr., M., Ortiz, P.A., Campaner, M., Takeda, G.F., Paiva, F., Nunes, V.L.B., Camargo, E.P., Teixeira, M.M.G. (2009). Trypanosoma rangeli isolates of bats from Central Brazil: Genotyping and phylogenetic analysis enable description of a new lineage using spliced-leader gene sequences. Acta Tropica 109(3), 199- 207.https://doi.org/10.1016/j.actatropica.2008.11.005
Marcili, A., Lima, L., Cavazzana, M., Junqueira, A.C., Veludo, H.H., Maia Da Silva, F., Campaner, M., Paiva, F., Nunes, V.L., Teixeira
, M.M. (2009). A new genotype of Trypanosoma cruzi associated with bats evidenced by phylogenetic analyses using SSU rDNA, cytochrome b and Histone H2B genes and genotyping based on ITS1 rDNA. Parasitology, 136(6), 641-55. https://doi.org/10.1017/S0031182009005861
Marinkelle, C.J. (1968). Pathogenicity of Trypanosoma rangeli for Rhodnius prolixus Stal in nature. Journal of Medical Entomology, 5(4), 497- 499. https://doi.org/10.1093/jmedent/5.4.497
Mello, C.B., García, E.S., Ratcliffe, N.A., Azambuja, P. (1995). Trypanosoma cruzi and Trypanosoma rangeli: Interplay with hemolymph components of Rhodnius prolixus. Journal of Invertebrate Pathology 65(3), 261-8. https://doi.org/10.1006/jipa.1995.1040
Mello, C.B., Azambuja, P., Garcia, E.S., Ratcliffe, N.A. (1996). Differential in vitro and in vivo behavior of three strains of Trypanosoma cruzi in the gut and hemolymph of Rhodnius prolixus. Experimental Parasitology, 82(2), 112-121. https://doi.org/10.1006/expr.1996.0015
Montandon, C.E., Barros, E., Vidigal, P.M., Mendes, M.T., Anhê, A.C., de Oliveira Ramos, H.J., de Oliveira, C.J., Mafra, C. (2016). Comparative proteomic analysis of the saliva of the Rhodnius prolixus, Triatoma lecticularia and Panstrongylus herreri triatomines reveals a high interespecific functional biodiversity. Insect Biochemistry and Molecular Biology, 71, 83-90. https://doi.org/10.1016/j.ibmb.2016.02.009
Mesquita, R.D., Vionette-Amaral, R.J., Lowenberger, C., Rivera-Pomar, R., Monteiro, F.A., Minx, P., Spieth, J., Carvalho, A.B., Panzera, F., Lawson, D., Torres, A.Q., Ribeiro, J.M., Sorgine, M.H., Waterhouse, R.M., Montague, M.J., Abad-Franch, F., Alves-Bezerra, M., Amaral, L.R., Araujo, H.M., …Oliveira, P.L. (2015). Genome of Rhodnius prolixus, an insect vector of Chagas disease, reveals unique adaptations to hematophagy and parasite infection. Proceedings of National Academy of Sciences U S A., 112(48), 14936-14941. https://doi.org/10.1073/pnas.1506226112.
Mwangi, V.I., Martinez, E.G., Leda, R.L., Catunda, M.E.S.L.A., Días, A.S., Padron, Antonio. Y., Guerra, M.D.G.V.B. (2023). Resisting an invasion: A review of the triatomine vector (Kissing bug) defense strategies against a Trypanosoma sp infection. Acta Tropica. 238, 106745. https://doi.org/10.1016/j.actatropica.2022.106745
Padilla, C.P., Alvarado, U., Ventura, G., Luna-Caipo D., Suárez M., Tuñoque, J.R., Ruelas-Llerena, N., Fachin, L.A., Huiza, A., Gonzales, L., Carranza, J.C., Vallejo, G.A., Cáceres, A.G. (2017). Identificación de unidades de tipificación discretas (DTU) de Trypanosoma cruzi en triatominos colectados en diferentes regiones naturales del Perú. Biomédica, 37 (Suplemento 2), 167-179. https://doi.org/10.7705/biomedica.v34i2.3559
Pulido, X.C., Pérez, G., Vallejo, G.A. (2008). Preliminary characterization of a Rhodnius prolixus hemolymph trypanolytic protein, this being a determinant of Trypanosoma rangeli KP1(+) and KP1(-) subpopulations’ vectorial ability. Memórias do Instituto Oswaldo Cruz, 103(2), 172-9. https://doi.org/10.1590/s0074-02762008000200008
Rassi Jr, A., Rassi, A., & Marin-Neto, J. A. (2010). Chagas disease. The Lancet, 375(9723), 1388-1402. https://doi.org/10.1016/S0140-6736(10)60061-X
Ribeiro, J.M., Andersen, J., Silva-Neto, M.A., Pham, V.M., Garfield, M.K., Valenzuela, J.G. (2004). Exploring the sialome of the blood-sucking bug
Rhodnius prolixus. Insect Biochemestry and Molecular Biology, 34(1):61-79. https://doi.org/10.1016/j.ibmb.2003.09.004
Rojas-Pirela, M., Kemmerling, U., Quiñones, W., Michels, P.A.M., Rojas, V. (2023). Antimicrobial Peptides (AMPs): Potential Therapeutic Strategy against Trypanosomiases? Biomolecules, 13(4), 599. https://doi.org/10.3390/biom13040599
Rueda, K., Trujillo, J.E., Carranza, J.C., Vallejo, G.A. (2014). Transmisión oral de Trypanosoma cruzi: una nueva situación epidemiológica de la enfermedad de Chagas en Colombia y otros países suramericanos. Biomédica, 34(4), 631-41. https://doi.org/10.1590/S0120-41572014000400017
Salazar-Antón, F., Urrea, D.A., Guhl, F, Arévalo, C., Azofeifa, G., Urbina, A., Blandón-Naranjo, M., Sousa, O.E., Zeledón, R., Vallejo, G.A. (2009). Trypanosoma rangeli genotypes association with Rhodnius prolixus and R. pallescens allopatric distribution in Central America. Infection Genetics and Evolution, 9(6),1306-10. https://doi.org/10.1016/j.meegid.2009.09.002
Salcedo-Porras, N., Lowenberger, C. (2019). The innate immune system of kissing bugs, vectors of chagas disease. Developmental and Comparative Immunology, 98,119-128. https://doi.org/10.1016/j.dci.2019.04.007
Sánchez, I.P., Pulido, X.C., Carranza, J.C., Triana, O., Vallejo, G.A. (2005). Inmunidad Natural de Rhodnius prolixus (Hemiptera: Reduviidae: Triatominae) frente a la infección con Trypanosoma (Herpetosoma) rangeli KP1(-) aislados de Rhodnius pallescens, R. colombiensis y R. ecuadoriensis. Revista de la Asociación Colombiana de Ciencias Biológicas, 17, 108-118.
Santiago, P. B., de Araújo, C. N., Charneau, S., Praça, Y. R., Bastos, I. M., Ribeiro, J. M., & Santana, J. M. (2020). The pharmacopea within triatomine salivary glands. Trends in Parasitology, 36(3), 250-265. https://doi.org/10.1016/j.pt.2019.12.014
Santos, D.V., Gontijo, N.F., Pessoa, G.C.D., Sant’Anna, M.R.V., Araujo, R.N., Pereira, M.H., Koerich, L.B. (2022). An updated catalog of lipocalins of the chagas disease vector Rhodnius prolixus (Hemiptera, Reduviidae). Insect Biochemistry and Molecular Biology, 146, 103797. https://doi.org/10.1016/j.ibmb.2022.103797
Suárez-Quevedo, Y., Barbosa-Vinasco, H.J., Gutiérrez-Garnizo, S.A,, Olaya-Morales, J.L,, Zabala-González, D., .Carranza-Martínez, J.C., Guhl-Nannetti, F., Cantillo-Barraza, O., Vallejo, G.A. (2020). Innate trypanolytic factors in triatomine hemolymph against Trypanosoma rangeli and T. cruzi: A comparative study in eight Chagas disease vectors. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 44(170), 88-104. https://doi.org//10.18257/raccefyn.1097
Urrea, D.A., Herrera, C.P., Falla, A., Carranza, J.C., Cuba-Cuba, C., Triana-Chávez, O., Grisard, E.C., Guhl, F., Vallejo, G.A. (2011). Sequence analysis of the spliced leader intergenic region (SL-IR) and random amplified polymorphic DNA (RAPD) of Trypanosoma rangeli strains isolated from Rhodnius ecuadoriensis, R. colombiensis, R. pallescens and R. prolixus suggests a degree of co-evolution between parasites and vectors. Acta Tropica, 120(1-2), 59-66. https://doi.org/10.1016/j.actatropica.2011.05.016
Vallejo, G.A., Marinkelle C.J., Guhl F., de Sánchez, N. (1986). Mantenimiento en el laboratorio de Trypanosoma (Herpetosoma) rangeli Tejera, 1920. Revista de Biología Tropical, 34(1), 75-81
Vallejo, G.A., Guhl, F., Carranza, J.C., Lozano, L.E., Sanchez, J.L., Jaramillo, J.C., Gualtero, D., Castañeda, N., Silva, J.C., Steindel, M. (2002). kDNA markers define two major Trypanosoma rangeli lineages in Latin-America. Acta Tropica, 81, 77-82. https://doi.org/10.1016/s0001-706x(01)00186-3
Vallejo, G.A., Guhl, F., Carranza, J.C., Herrera, C., Urrea, D.A., Falla, A., Zabala, D., Villa, L.M. (2009a). Trypanosoma cruzi population variability in Colombia: possible co-evolution in different vector species. Revista de la Sociedad Brasilera de Medicina Tropical, 42 (Suplemento II), 27-34.
Vallejo, G.A., Guhl, F., Schaub, G.A. (2009b). Triatominae-Trypanosoma cruzi/T. rangeli: vector-parasite interactions. Acta Tropica, 110(2-3), 137-147. https://doi.org/10.1016/j. actatropica.2008.10.001
Vallejo, G.A., Suárez, Y., Olaya, J.L., Gutiérrez, S.A., Carranza, J.C. (2015). Trypanosoma rangeli: un protozoo infectivo y no patógeno para el humano que contribuye al entendimiento de la transmisión vectorial and la infección por Trypanosoma cruzi, agente causal de la enfermedad de Chagas. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 39(150), 111-122.
Velásquez-Ortiz, N., Hernández, C., Cantillo-Barraza, O., Ballesteros, N., Cruz-Saavedra, L., Herrera, G., Buitrago, L.S., Soto, H., Medina, M., Palacio, J., González, M.S., Cuervo, A., Vallejo, G.A., Zuleta Dueñas, L., Urbano, P., Muñoz, M., Ramírez, J.D. (2022). Trypanosoma cruzi Parasite Burdens of Several Triatomine Species in Colombia. Tropical Medicine and Infectious Disease 7(12), 445. https://doi.org/10.3390/tropicalmed7120445
Vieira, C. S., Waniek, P. J., Castro, D. P., Mattos, D. P., Moreira, O. C., & Azambuja, P. (2016). Impact of Trypanosoma cruzi on antimicrobial peptide gene expression and activity in the fat body and midgut of Rhodnius prolixus. Parasites & Vectors, 9, 119. https://doi.org/10.1186/s13071-016-1398-4
Whitten, M.M.A., Mello, C.B., Gomes, S.A.O., Nigam, Y., Azambuja, P., Garcia, E.S., Ratcliffe, N.A. (2001). Role of superoxide and reactive nitrogen intermediates in Rhodnius prolixus (Reduviidae)/Trypanosoma rangeli interactions. Experimental Parasitology. 98, 44-57. https://doi.org/10.1006/expr.2001.4615.
Whitten, M., Sun, F., Tew, I., Schaub, G., Soukou, C., Nappi, A., Ratcliffe, N. (2007). Differential modulation of Rhodnius prolixus nitric oxide activities following challenge with Trypanosoma rangeli, T. cruzi and bacterial cell wall components. Insect Biochemistry and Molecular Biology, 37, 440-452. https://doi.org/10.1016/J. IBMB.2007.02.001.
WHO (2022). Chagas disease (also known as American trypanosomiasis). Disponible en https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis). Recuperado el 8 de febrero de 2023.
Zabala, D, Carranza, J.C., Urrea, D.A., Guhl, F., Jaramillo, N., Teixeira, M.M., Vallejo, G.A. (2011). Respuesta inmune diferencial de triatominos contra Trypanosoma cruzi y T. rangeli. Revista de la Asociación Colombiana de Ciencias Biológicas (Col.). 23, 134-143.

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Derechos de autor 2023 Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales